ГЛАВА 2 АСПЕТИКА И АНТИСЕПТИКА
ГЛАВА 2 АСПЕТИКА И АНТИСЕПТИКА
Среди осложнений в хирургии наиболее часто встречаются инфекционные. Они могут привести к смертельному исходу, несмотря на блестяще выполненную операцию. Предупреждение таких осложнений - главный принцип хирургии, в основе которого лежат асептика и антисептика.
Асептика - комплекс мероприятий, направленных на предупреждение попадания возбудителей инфекции в рану или организм человека.
Антисептика - комплекс мероприятий, направленных на борьбу с ин- фекцией в организме человека, предупреждение или ликвидацию инфекционного воспалительного процесса.
Оба метода представляют собой единое целое в профилактике хирургической инфекции. Рассматривать их следует с точки зрения взаимоотношения источника инфекции, путей её передачи и восприимчивости организма.
Любая наука проходит определённые этапы развития. В хирургии коренной переворот наступил с внедрением антисептики и асептики, определивших грань между доантисептическим и антисептическим пе- риодами. И это не случайно, так как летальность в доантисептический период даже после небольших разрезов или проколов достигала более 80%. В XIX веке даже у такого хирурга, как Бильрот, летальность после мастэктомии и струмэктомии составляла 50%. Больные умирали от нагноений ран, рожи, гангрены, сепсиса. Приоритет в разработке антисептического метода принадлежит английскому хирургу Джозефу Листеру (1829-1912). Его работы произвели переворот в хирургии и положили начало новому этапу в её развитии.
Хирурги XVIII века отождествляли гнойные осложнения ран (флегмону, рожу, столбняк и др.) с гниением, обусловленным, по их мнению, воздействием на рану воздуха, который охлаждает и высушивает рану. Поэтому они рекомендовали накладывать окклюзионные, воздухонепроницаемые повязки, а английский хирург Бенджамен Белл советовал производить перевязки как можно быстрее, чтобы ограничить время воздействия воздуха (особенно «нечистого») на рану. Его соотечественник Прайнгль считал, что для очищения воздуха надо лучше вентилировать госпитальные помещения.
Французский хирург Путо (XVIII век) установил важный факт, имевший значение для последующего формирования основных положений контактного инфицирования ран: гнойное раневое отделяемое от одного больного при попадании в рану другого вызывает у последнего гнойное воспаление. Так, при использовании уже бывшего в употреблении перевязочного материала или материала, который загрязнён руками, «зараженными дурным воздухом больных», происходит заражение ран.
Предположение о роли микробов в развитии гнойных осложнений ран высказывали и другие хирурги. Н.И. Пирогов во время Крымской войны (1853-1856) писал: «...можно смело утверждать, что большая часть раненых умирает не столько от самих повреждений, сколько от госпитальной заразы... От нас недалеко то время, когда тщательное изучение травматических и госпитальных миазм даст хирургам другое направление». Н.И. Пирогов считал, что зараза («миазмы») передаётся через руки, бельё, матрацы, перевязочный материал, и рекомендовал в связи с этим гигиенические мероприятия. Он применял для лечения ран спирт, йод, нитрат серебра, способные уничтожить «миазмы».
Приоритет в системном применении антисептики принадлежит венгерскому врачу-акушеру И. Земмельвайсу, применившему в 1847 г. для обеззараживания родовых путей родильниц, рук, инструментов и всех других предметов, соприкасающихся с родовыми путями, раствор хлорной извести. К этому методу И. Земмельвайс подошёл не случайно: он экспериментально доказал наличие загрязнённого начала в выделениях из матки женщин, больных родильной горячкой (сепсисом): кролики, в кровь которых вводили выделения, погибали. Исходя из этого, И. Земмельвайс считал, что перенос заразного начала от больной родильницы к здоровой, проникновение его через обширную раневую поверхность, которой является матка после родов, приводят к развитию сепсиса. Применение предложенного И. Земмельвайсом метода обработки привело к снижению летальности в его клинике на треть. Однако метод не получил распространения, так как большинство хирургов считали причиной заражения ран воздушную инфекцию.
Непосредственной предпосылкой к разработке Дж. Листером антисептического метода в хирургии послужило открытие в 1863 г. причины брожения и гниения Луи Пастером, который установил, что в их основе лежат проникновение и жизнедеятельность специфических микроорганизмов. Л. Пастер разработал и методы предупреждения этих процессов. Несомненная заслуга Дж. Листера состоит в том, что он перенёс открытие Л. Пастера в хирургию, провёл параллели между гниением и нагноением ран, считая причиной нагноения проникновение извне ка-
ких-то болезнетворных начал. Исходя из этого, он предложил закрывать рану специальной повязкой, не пропускающей воздух, а для предупреждения гниения в ране использовать фенол. Выбор фенола не был случайным - она является составной частью дёгтя, а дёгтем в то время заливали помойные ямы для предупреждения гниения в них. За несколько лет до этого Лемер установил дезинфицирующее действие фенола. Использовав фенол для лечения открытых переломов, Дж. Листер получил прекрасный результат. После двухлетних исследований он создал систему профилактики гнойных осложнений ран и в 1867 г. опубликовал труд под названием «О новом способе лечения переломов и гнойников с замечаниями о причинах нагноения». Суть профилактики заключалась в борьбе с воздушной и контактной инфекцией и сводилась к уничтожению бактерий с помощью фенола в воздухе, на руках, инструментах и других предметах, соприкасающихся с раной. Эффективность системы профилактики инфекционных осложнений с помощью метода Листера убедительно подтверждалась снижением в несколько раз частоты смертельных исходов от гнойных осложнений.
И несмотря на то, что и раньше высказывались предположения о роли каких-то внешних факторов в развитии септических осложнений и предлагались те или иные средства для предупреждения осложнений, заслуга Дж. Листера в том, что он создал систему профилактики - антисеп- тический метод. Основными компонентами этой системы были многослойная листеровская повязка, обработка рук, инструментов, стерилизация воздуха в операционной. Повязка состояла из следующих слоёв: к ране прилегала повязка из шёлка, пропитанного 5% раствором фенола, поверх неё накладывали 8 слоёв марли, пропитанной тем же раствором с добавлением канифоли, покрывали прорезиненной тканью или клеёнкой и фиксировали марлевыми бинтами, пропитанными фенолом. Руки хирурга, инструменты, перевязочный и шовный материал мыли 2-3% раствором фенола. Операционное поле обрабатывали тем же раствором. В операционной с помощью пульверизатора распыляли раствор фенола до и во время вмешательства для стерилизации воздуха.
Применение метода Листера привело к снижению частоты гнойных осложнений ран, но выявило и недостатки. Использование растворов фенола, кроме положительного, оказывало и отрицательное действие, вызывая общую интоксикацию больных, ожог тканей в области раны, поражение почек, заболевания хирургов (дерматит, ожоги, экзему рук). Предпринимались попытки заменить фенол другими веществами: раствором ртути дихлорида (сулемы), борной или салициловой кислоты, перманганата калия и др. Однако чем сильнее проявлялось антимик-
робное действие используемых средств, тем более выраженным было их токсическое влияние на организм.
В истории антисептики известны и драматические моменты. Так, высказанную Л. Пастером в 1880 г. мысль о том, что все гнойные воспаления имеют одного возбудителя, Э. Бергман подверг сомнению как недоказательную и поэтому сомнительную. Швейцарский хирург К. Гарре (1857-1928) для доказательства правоты Л. Пастера втёр себе в кожу левого предплечья микробную культуру стафилококка из колоний, полученных при посеве гноя больного остеомиелитом. На месте инфицирования развился большой карбункул, окружённый множественными мелкими фурункулами. При посеве гноя был выделен стафилококк. Врач выздоровел. Проведя эксперимент на себе, он опытным путём доказал, что стафилококки вызывают различные гнойные заболевания: абсцесс, фурункул, карбункул, остеомиелит.
Постепенно интерес к методу Листера и его модификациям утрачивался, и спустя 25 лет на смену ему пришёл асептический метод, который заключался в стерилизации всех предметов, соприкасающихся с раной. Основоположником асептики стал немецкий хирург Э. Бергман, работавший ранее в России. На конгрессе хирургов в Берлине в 1890 г. он доложил о новом методе борьбы с раневой инфекцией и продемонстрировал успешно прооперированных в асептических условиях больных. Председательствовавший на конгрессе Дж. Листер поздравил Э. Бергмана с успехом, назвав асептический метод блестящим завоеванием хирургии.
В основе предложенного асептического метода лежит принцип уничтожения микробной флоры на всех предметах, соприкасающихся с раной, воздействием высокой температуры (кипячением, действием горячего пара и др.). Начиная с 1892 г. метод асептики стал применяться во многих клиниках мира. Результаты были столь разительны, что появились призывы полностью отказаться от антисептического метода (борьба с инфекцией в организме человека) и даже исключить антисеп- тические средства из хирургической практики. Однако обойтись без них в хирургии оказалось невозможным: обработка рук хирурга и операционного поля, санация гнойных полостей и многие другие мероприятия невыполнимы без антибактериальных препаратов, тем более что со временем появились новые малотоксичные антисептические средства, а методы антисептики пополнились не только химическими, но и физическими средствами (лазер, ультразвук и др.).
Основные требования, предъявляемые к антисептическим средствам, следующие: бактерицидное или бактериостатическое действие на мик-
роорганизм; отсутствие раздражающего токсического влияния на ткани при местном применении; сохранение свойств при соприкосновении с биологическими жидкостями (кровью, экссудатом, гноем) и воздухом (они не должны быть летучими); кроме того, их производство должно быть дешёвым.
ИСТОЧНИКИ И ПУТИ РАСПРОСТРАНЕНИЯ ИНФЕКЦИИ В ХИРУРГИИ
Под источником инфекции понимают места обитания, развития, размножения микроорганизмов. По отношению к организму больного (раненого) возможны экзогенные (вне организма) и эндогенные (внутри него) источники хирургической инфекции.
Основные источники экзогенной инфекции - больные с гнойно-воспалительными заболеваниями, бациллоносители, реже - животные (схема 1). От больных с гнойно-воспалительными заболеваниями микроорганизмы попадают во внешнюю среду (воздух, окружающие предметы, руки медицинского персонала) с гноем, слизью, мокротой и другими выделениями. При несоблюдении определённых правил поведения, режима работы, специальных методов обработки предметов, инструментов, рук, перевязочного материала микроорганизмы могут попасть в рану и вызвать гнойно-воспалительный процесс. Микроорганизмы проникают в рану из внешней среды различными путями: контактным - при соприкосновении с раной инфицированных предметов, инструментов, перевязочного материала, операционного белья; воздушным - из окружающего воздуха, в котором микроорганизмы находятся; имплантационным -
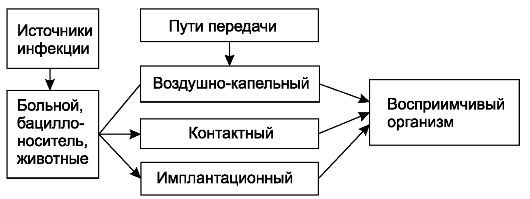
Схема 1. Экзогенное инфицирование.
инфицирование при оставлении в ране на длительное время или постоянно тех или иных предметов (шовного материала, костных фиксаторов и других имплантатов), инфицированных при выполнении операции или вследствие нарушения правил стерилизации.
Животные как источник хирургической инфекции играют меньшую роль. При обработке туш больных животных возможно заражение си- бирской язвой. С испражнениями животных в окружающую среду могут попасть возбудители столбняка, газовой гангрены. На окружающих предметах, в земле эти микроорганизмы длительное время находятся в виде спор. При случайных травмах они могут проникнуть в рану с зем- лёй, обрывками одежды и другими предметами и вызвать специфическое воспаление.
Источником эндогенной инфекции являются хронические воспалительные процессы в организме, как вне зоны операции (заболевания кожи, зубов, миндалин и др.), так и в органах, на которых проводится вмешательство (аппендицит, холецистит, остеомиелит и др.), а также микрофлора полости рта, кишечника, дыхательных, мочевых путей и др. Пути инфицирования при эндогенной инфекции - контактный, гематогенный, лимфогенный (схема 2).
Контактное инфицирование раны возможно при нарушении техники операции, когда в рану могут попасть экссудат, гной, кишечное содержимое, или при переносе микрофлоры на инструментах, тампонах, перчатках вследствие несоблюдения мер предосторожности. Из очага
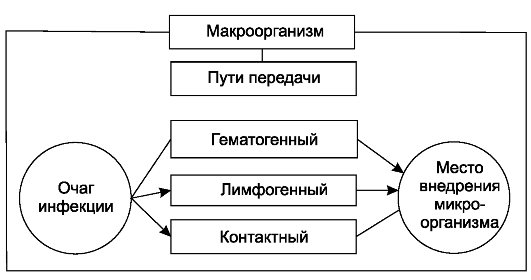
Схема 2. Эндогенное инфицирование.
воспаления, расположенного вне зоны операции, микроорганизмы могут быть занесены с лимфой (лимфогенный путь инфицирования) или с током крови (гематогенный путь инфицирования).
Методами асептики ведут борьбу с экзогенной инфекцией, методами антисептики - с эндогенной инфекцией, в том числе проникшей в организм из внешней среды, как это бывает при случайных ранениях. Для успешной профилактики инфекции необходимо, чтобы борьба велась на всех этапах (источник инфекции - пути инфицирования - организм) путём комбинации методов асептики и антисептики.
Для предупреждения инфицирования окружающей среды при наличии источника инфекции - больного с гнойно-воспалительным забо- леванием - необходимы в первую очередь организационные мероприятия: лечение таких больных в специальных отделениях хирургической инфекции, выполнение операций и перевязок в отдельных операционных и перевязочных, наличие специального персонала для лечения больных и ухода за ними. Такое же правило существует и для хирургии в амбулаторных условиях: приём больных, лечение, перевязки и операции выполняют в специальных кабинетах.
Бациллоносителей (к ним относят людей практически здоровых, но выделяющих в окружающую среду патогенную микрофлору, чаще всего из носа, глотки) необходимо отстранить от работы в хирургических уч- реждениях и провести соответствующее лечение, вернуться к работе им разрешают лишь после бактериологического контроля.
АСЕПТИКА
Препараты, оказывающие антибактериальное действие на гноеродную микрофлору, делят на две группы - химиотерапевтические средства (см. Антисептика) и химические средства для дезинфекции и стерилизации.
Препараты, применяемые для дезинфекции и стерилизации, используют для предупреждения попадания инфекции в рану, т.е. для борьбы с инфекцией на путях её передачи. Некоторые химические антибакте- риальные средства могут применяться в качестве как химиотерапевтических, так и средств для дезинфекции и стерилизации (например, хлоргексидин, водорода пероксид и др.).
Из химических средств для дезинфекции и стерилизации широко используют в хирургии препараты йода: 5% и 10% спиртовой раствор применяют для смазывания кожи вокруг раны, обработки поверхностных ран и ссадин, операционного поля.
Йод+калия йодид содержит около 4,5% свободного йода, перед упот- реблением его разводят дистиллированной водой в соотношении 1:4,5. Препарат применяют для обработки операционного поля.
Повидон-йод - соединение йода с поливинилпирролидоном, содержит 0,1-1% йода. Используют для обработки рук, операционного поля.
Хлорамин Б (Chloraminum) используют в виде (1-3%) раствора для дезинфекции рук, предметов ухода за больными, неметаллических инструментов, помещений.
Надмуравьиная кислота в комплексе с пероксидом водорода (первомур, препарат С-4) предназначена для обработки рук перед операцией. Готовят специальный раствор (см. Подготовка рук к операции). Препарат применяют также для обработки хирургических инструментов и резиновых перчаток.
Этанол (Spiritus aethylicus) используют в виде 70% или 96% раствора для обработки рук, операционного поля, оптических инструментов, шовного материала.
Формалин (Formalinum) - раствор, содержащий 36,5-37,5% формальдегида. Применяют в виде 0,5-5% раствора для дезинфекции перчаток, инструментов, катетеров, дренажей.
Дегмицид (Degmicidum) содержит 30% дегмина (четвертичное аммониевое соединение). Применяют 1% раствор (т.е. в разведении 1:30) для обработки операционного поля и рук хирурга.
Бензалкония хлорид в виде 1% или 10% раствора применяют для сте- рилизации инструментов (в разведении 1:1000; экспозиция - 30 мин), резиновых перчаток, дренажей (в разведении 1:4000; экспозиция - 24 ч). С целью предупреждения коррозии инструментов добавляют натрия карбонат из расчёта 2 г на 1 л рабочего раствора.
Хлоргексидин выпускается в виде биглюконата (Chlorhexidini bigluconas). Синоним - гибитан. Выпускается в виде 20% раствора. Для обработки операционного поля и дезинфекции инструментов раствор разводят 70% раствором этанола в отношении 1:40. Полученным 0,5% водно-спиртовым раствором обрабатывают операционное поле 2 раза с интервалом 2 мин. Инструменты стерилизуют путём погружения их в раствор на 2 мин.
Из современных средств для дезинфекции и предстерилизационной подготовки используют «Аламинол» (Россия). Действующее начало составляют 5% раствор алкилдиметилбензиламоний хлорид и 8% раствор глиоксала, а также поверхностно-активное вещество, рН 3,5. Обладает широким бактерицидным действием по отношению к неспецифической гноеродной флоре, возбудителям туберкулёза, грибам, вирусам, а также моющими свойствами.
Применяют для дезинфекции поверхностей в помещениях, предметов обстановки, санитарно-технического оборудования, белья, хирургических инструментов, эндоскопов. Концентрация средства по препарату 1-10%, препарат растворяют в воде.
Применение - протирание поверхностей или погружение предметов в дезинфицирующий раствор. Раствор применяют многократно. Контроль качества предстерилизационной подготовки проводят с ис- пользованием пробы на остаточную кровь (бензидиновой, амидопириновой пробы). Время обработки (погружение) изделий из металла, пластмасс - 60 мин при концентрации 5%, загрязнённого белья (замачивание) - 120 мин при концентрации 5%.
Дезинфицирующее средство «Кеми-сайд» (Россия). Действующие начала 1,1-бифенид - 3-3,5%, 5-хлор-2-гидроксидифенилметан - 2,6-3,2%. Спектр бактерицидного действия широкий: включает палочку туберкулё- за, вирусы, грибы. Препарат разводят водой, готовят 0,5%, 1%, 2% раствор.
Применяют для дезинфекции аппаратов, приборов, санитарно-технического оборудования, поверхностей стен, столов, пола. Способ обеззараживания - одноили двукратное протирание.
Дезинфицирующее средство «Лизафин-специаль» (Россия). Действующие начала: алкилдиметилбензиламмоний хлорид, глютаровый альдегид, гликосоль, спирт денатурированный.
Антимикробный спектр - бактерии, включая палочку туберкулёза, вирусы, грибы. Обладает моющим свойством.
Примененяют в концентрациях 1-5% по препарату. Используют для дезинфекции поверхностей (пола, стен), хирургических столов, мебели, предметов ухода за больными. Применяют для предстерилизацион- ной обработки предметов из стекла, металла, пластмасс - эндоскопов, инструментов. Дезинфекцию проводят путём замачивания, протирания, погружения. Время обработки инструментов, эндоскопов при использовании 1% раствора - 60 мин, 1,5% - 30 мин, 2% - 15 мин при погружении в раствор препарата.
Борьба с микрофлорой на путях воздушного инфицирования
Хирургический стационар включает несколько основных функциональных подразделений: операционный блок, палаты хирургического отделения, перевязочные, процедурные и др.
Успех профилактики экзогенного инфицирования у хирургических больных возможен при условии комплексного подхода на всех этапах
пребывания больного в стационаре: приёмное отделение - хирургическое отделение - диагностические кабинеты - перевязочная - операционная.
Вся работа хирургического стационара по профилактике экзогенной инфекции начинается с разделения больных на «чистых» и «гнойных». Больных с гнойно-воспалительными хирургическими заболеваниями госпитализируют в гнойные (инфекционные) хирургические отделения, которые полностью изолированы от чистых отделений. В них работает свой персонал, имеются свои перевязочные, операционные, процедурные помещения (для выполнения вливаний, инфузий, взятия крови для лабораторных исследований и т.д.). Это отделение должно находиться в отдельном помещении. При наличии лишь одного хирургического отделения в нём выделяют специальные палаты для инфицированных больных, палаты располагаются в одной его части (отсеке) с отдельной перевязочной в том же отсеке.
В приёмном отделении, где проводятся первичный осмотр и обследование поступивших, сразу же разделяют потоки больных на «чистых» и «гнойных». В приёмном отделении выполняют санитарно-гигиеническую обработку, которая предусматривает мытьё больных (гигиеническую ванну или душ) и их переодевание. При определённых условиях (педикулёз, чесотка) проводят специальную обработку, а также дезинфекцию и дезинсекцию белья.
В хирургическом отделении для поддержания санитарного режима проводят ежедневную влажную уборку с применением антисептических средств и 1 раз в 3 дня - влажную уборку стен (протирание влажной щёткой, тряпкой). Влажной обработке подвергают мебель отделения. Регулярное проветривание, использование кондиционеров позволяют снизить степень бактериальной обсеменённости помещений отделения. Важное значение имеет санитарный режим для персонала: душ перед началом работы, сменные одежда и обувь, ношение колпаков. Важное средство профилактики - обследование персонала на бациллоносительство (мазки из носа, глотки) и изоляция сотрудников с простудными и гнойничковыми заболеваниями.
Основной путь инфицирования ран в операционной - контактный (около 90% случаев), лишь в 10% случаев инфицирование происходит воздушным путём. Каждый член хирургической бригады, несмотря на специальную подготовку к операции, стерильное операционное бельё, соблюдение режима работы, выделяет в окружающий воздух до 1500 микроорганизмов в минуту. За 1-1,5 ч работы одной хирургической бригады бактериальная загрязнённость воздуха в операционной увеличи-
вается на 100%. Допустимое количество микроорганизмов в 1 м3 воздуха операционной перед началом работы не должно превышать 500, во время операции - 1000 при условии отсутствия в воздухе патогенных микроорганизмов. Поддерживать такой уровень удаётся с помощью специальных устройств системы вентиляции, режима работы и уборки операционной, дезинфекции воздуха и предметов.
Хирургический стационар включает несколько основных функциональных подразделений: операционный блок, хирургические отделения, перевязочные, процедурные.
Операционный блок - набор специальных помещений для выполнения операций и проведения обеспечивающих их мероприятий. Операционный блок должен располагаться в отдельном помещении или крыле здания, соединённом коридором с хирургическими отделениями, или на отдельном этаже многоэтажного хирургического корпуса. Чаще имеются разделённые между собой операционные для выполнения вмешательств у «чистых» и «гнойных» больных, хотя более целесообразно пре- дусмотреть отдельный, изолированный операционный блок при гнойных хирургических отделениях.
Операционный блок отделён от хирургических отделений специальным тамбуром - чаще это часть коридора, в которую выходят помещения операционного блока общего режима. Для обеспечения режима сте- рильности в операционном блоке выделяют специальные функциональные зоны (схема 3).
1. Зона стерильного режима объединяет операционную, предоперационную и стерилизационную. В помещениях этой зоны производят следующие действия: в операционной - непосредственно операции; в предоперационной - подготовку рук хирурга к операции; в стерилизационной - стерилизацию инструментов, которые понадобятся в ходе операции или используются повторно.
2. В зону строгого режима входят такие помещения, как санпропускник, состоящий из комнат для раздевания персонала, душевых установок, кабин для надевания стерильной одежды. Эти помещения располагаются последовательно, и персонал выходит из кабины для одевания прямо или через коридор в предоперационную. В эту же зону входят помещения для хранения хирургических инструментов и аппаратов, наркозной аппаратуры и медикаментов, кабинет переливания крови, помещения для дежурной бригады, старшей операционной сестры, санитарный узел для персонала операционного блока.
3. Зона ограниченного режима, или техническая зона, объединяет производственные помещения для обеспечения работы операционного бло-
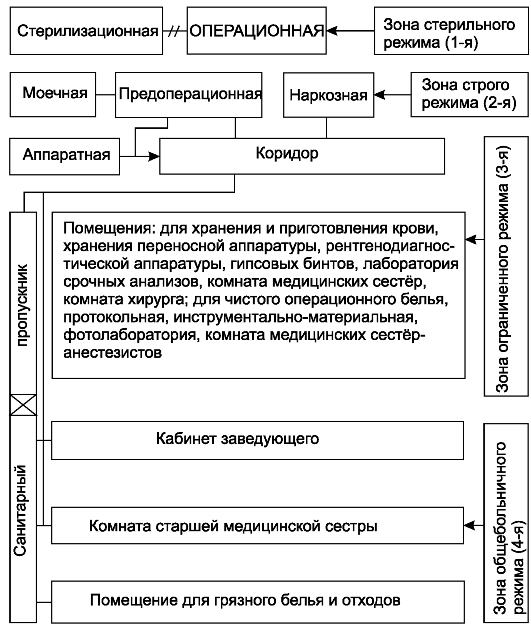
Схема 3. Устройство операционного блока.
ка: здесь находятся аппаратура для кондиционирования воздуха, вакуумные установки, установки для снабжения операционной кислородом и наркотическими газами, здесь же располагаются аккумуляторная подстанция для аварийного освещения, фотолаборатория для проявления рентгеновских плёнок.
4. В зоне общего режима находятся кабинеты заведующего, старшей медицинской сестры, помещения для разбора грязного белья и др.
Режим работы операционного блока предусматривает ограничение его посещений. В зоне стерильного режима должны находиться только участвующие в операции хирурги и их ассистенты, операционные сёст- ры, анестезиологи и анестезисты, санитарка для текущей уборки опера- ционной. В зону стерильного режима допускаются студенты и стажирующиеся врачи. Работники операционного блока носят специальную одежду: халаты или куртки и брюки, отличающиеся по цвету от одежды сотрудников других отделений.
Контроль за режимом стерильности операционного блока проводят периодически путём бактериологического исследования воздуха операционной, смывов со стен, потолка, аппаратов и приборов. Материалы для посева берут 1 раз в месяц; еженедельно, кроме того, выборочно делают посев с рук работников блока для контроля стерильности.
Стерильный режим в операционной достигается за счёт предупреждения занесения сюда из других помещений микроорганизмов и их распространения. Специальное устройство операционного блока, исполь- зование стерильных шлюзов перед входом в операционную, подготовка больного к операции (мытьё, смена белья, сбривание волос в области операционного поля), подготовка к операции персонала (обязательное переодевание, использование стерильного белья, надевание бахил, шапочек, масок, обработка рук) значительно ограничивают проникновение микроорганизмов в операционную.
Микроорганизмы в воздухе, на предметах очень редко находятся в изолированном виде - в основном они фиксированы на микроскопических частицах пыли. Поэтому тщательное удаление пыли, как и пре- дупреждение проникновения её в операционную, уменьшают степень микробного загрязнения.
В операционной предусмотрены следующие виды уборки: предварительная, текущая, послеоперационная, заключительная и генеральная.
Перед началом операции влажной тряпкой протирают все предметы, приборы, подоконники, удаляют осевшую за ночь пыль (предвари- тельная уборка). В ходе операции постоянно убирают упавшие на пол салфетки, шарики, инструменты (текущая уборка). В промежутке между операциями, когда больной вывезен из операционной, убирают бе- льё, салфетки, инструменты; влажной салфеткой, смоченной раствором антисептических средств, протирают операционный стол и накрывают его простынёй; пол протирают влажной тряпкой (послеоперационная уборка). По окончании рабочего дня производят заключительную убор-
ку, которая включает влажную уборку с протиранием потолка, стен, подоконников, всех предметов и аппаратуры, пола с использованием дезинфицирующих растворов (1-3% раствора пероксида водорода с синтетическим моющим средством, раствора бензалкония хлорида и др.) и последующим включением бактерицидных ламп.
В конце недели осуществляют генеральную уборку операционной. Начинают её с дезинфекции операционной: потолок, стены, все предметы, пол опрыскивают дезинфицирующим раствором, а затем удаляют его путём протирания. После этого проводят общую влажную уборку и включают бактерицидные ультрафиолетовые (УФ) лампы. Генеральная уборка может быть и внеочередной - при загрязнении опе- рационной гноем, кишечным содержимым, после операции у больных с анаэробной инфекцией (газовой гангреной).
Для облучения воздуха и предметов, находящихся в операционной, используют напольные (передвижные), настенные, потолочные бактерицидные УФ-лампы различной мощности (рис. 1). Бактерицидные лампы, снабжённые специальными экранами, защищающими от прямого действия УФ-лучей, могут работать при наличии людей в операционной.
Кроме бактерицидных ламп, для обеззараживания воздуха в операционной могут быть использованы аэрозоли бактерицидных веществ, распы-
Рис. 1. Бактерицидные ультрафиолетовые лампы: а - потолочная; б - напольная (передвижная) типа «Маяк».
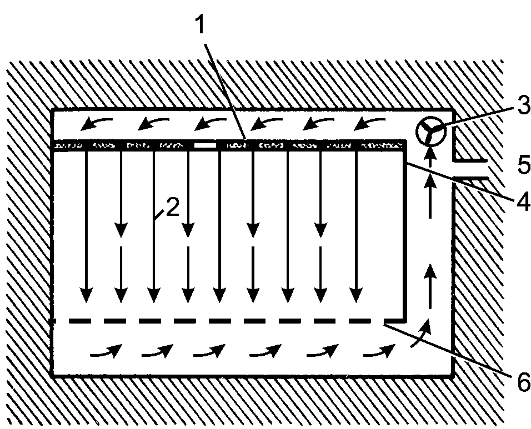
Рис. 2. Операционная с ламинарным потоком воздуха: 1 - фильтр; 2 - поток воздуха; 3 - вентилятор; 4 - предфильтр; 5 - отверстие для поступления наружного воздуха; 6 - перфорированный пол.
ляемые специальным аппаратом типа «Дезинфаль». В качестве бактерицидных веществ используют смесь, содержащую 3% раствор пероксида водорода и 0,5% молочной кислоты. Распыление должно проводиться накануне, в крайнем случае - не менее чем за 2 ч до начала операции.
Предупреждения загрязнения воздуха в операционной достигают механической системой вентиляции, осуществляемой путём подачи воздуха с улицы или за счёт его рециркуляции. С помощью приточной вен- тиляции воздух нагнетается через фильтры в операционную. Вместе с оседающей на фильтрах пылью удаляются фиксированные на ней микробы. Воздух выходит из операционной через естественные щели. Такое направление потока позволяет избежать проникновения загрязнён- ного воздуха из соседних с операционной помещений, в том числе из хирургических отделений. При отсутствии централизованной системы очистки воздуха от пыли и микробов могут быть использованы специальные передвижные воздухоочистители (ВОПР-1,5). За 15 мин работы аппарата количество микробов в операционной уменьшается в 7-10 раз.
Для выполнения некоторых вмешательств (таких, как пересадка органов, требующая в последующем применения иммунодепрессивных средств, имплантация протезов, операции при обширных ожогах) используют операционные с ламинарным потоком стерильного кондиционированного воздуха (рис. 2). Количество микроорганиз-
мов в таких операционных в десятки раз ниже, чем при обычной системе кондиционирования воздуха. Ламинарный поток обеспечивает за час 500-кратный обмен воздуха, который нагнетается под давле- нием 0,2-0,3 атм. через специальный фильтр, представляющий собой потолок операционной, и выходит через отверстия в полу. Этим создаётся постоянный вертикальный поток: в операционную поступает стерильный воздух, а направленный его поток уносит микроорганизмы, попавшие в воздух от больного или лиц, участвующих в операции. Ламинарный поток воздуха может быть как вертикальным, так и горизонтальным.
В старых операционных возможна установка специального боксаизолятора с ламинарным потоком воздуха: стены бокса из пластика или стекла не достигают пола, и нагнетаемый через фильтр-потолок стерильный воздух создаёт вертикальный ламинарный поток, который вытесняет имеющийся в боксе воздух в щели, образовавшиеся между его стенками и полом (рис. 3).
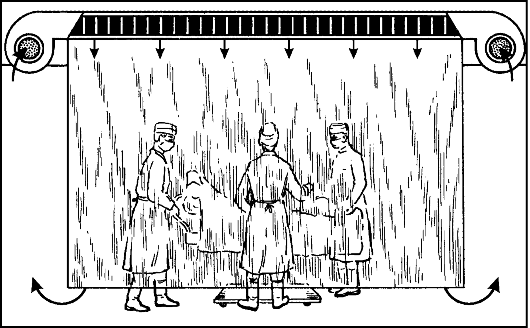
Рис. 3. Бокс-изолятор с ламинарным потоком воздуха, устанавливаемый в операционной.
Борьба с микрофлорой на этапах контактного инфицирования раны
Для предупреждения контактного инфицирования необходимо, чтобы было стерильным всё, что соприкасается с раной. Этого достигают специальной обработкой операционного белья, перевязочного и шовного материала, перчаток, инструментов, обработкой рук хирурга и операционного поля. Стерилизация (sterilis - бесплодный) - полное осво- бождение от микроорганизмов всех предметов, растворов, материалов. Дезинфекция предусматривает уничтожение патогенной микробной флоры. Стерилизация шовного материала направлена на профилактику как контактного, так и имплантационного инфицирования раны.
Стерилизация инструментов, перевязочного материала и белья включает следующие основные этапы: I - предстерилизационная подготовка материала; II - укладка и подготовка к стерилизации; III - стерилизация; IV - хранение стерильного материала. Все эти этапы выполняют в соответствии с отраслевым стандартом «Стерилизация и дезинфекция изделий медицинского назначения».
Стерилизация инструментов
Этап I - предстерилизационная подготовка
Цель предстерилизационной подготовки - тщательная механическая очистка инструментов, шприцев, инъекционных игл, систем для трансфузии, удаление пирогенных веществ и уничтожение вируса гепатита. Персонал должен работать в резиновых перчатках.
Бывшие в употреблении, но неинфицированные инструменты тщательно моют проточной водой щётками в отдельной раковине в течение 5 мин (инструменты, загрязнённые кровью, моют сразу, не допуская вы- сыхания крови) и затем на 15-20 мин замачивают в одном из специальных моющих растворов, подогретом до 50 ?С. Шприцы обрабатывают в разобранном виде.
После замачивания инструменты моют в том же растворе ершами, щётками (особенно тщательно обрабатывают замки, зубчики, насечки), затем в течение 5 мин ополаскивают тёплой водой и в течение 1 мин прополаскивают в дистиллированной воде. После этого инструменты и шприцы помещают в суховоздушный стерилизатор при температуре 85 ?С для высушивания, после чего они готовы к стерилизации.
Инструменты и шприцы, загрязнённые гноем или кишечным содержимым, предварительно помещают в эмалированные ёмкости с 0,1% рас-
твором диоцида на 30 мин. Затем в этом же растворе их моют ершами, щётками, ополаскивают проточной водой и опускают в один из моющих растворов, проводя дальнейшую обработку по описанной выше методике.
Инструменты после операции, проведённой у больного с анаэробной инфекцией, замачивают на 1 ч в специальном растворе, состоящем из 6% раствора пероксида водорода и 0,5% раствора моющего средства, затем моют щёткой в этом же растворе и кипятят 90 мин. Лишь после этого инструменты готовят к стерилизации так же, как неинфицированные инструменты. Через 1 сут (время для прорастания спор) их подвергают автоклавированию или кипячению (дробная стерилизация).
Стерилизацию игл проводят вынужденно, когда нет возможности применить иглы разового использования.
Пункционные, инъекционные иглы после употребления промывают с помощью шприца тёплой водой, а затем 1% раствором натрия гидрокарбоната, канал иглы прочищают мандреном, промывают 0,5% раствором аммиака и проточной водой. После этого иглу со вставленным мандреном кипятят в течение 30 мин в 2% растворе натрия гидрокарбоната, а через 8-12 ч - повторно в дистиллированной в течение 40 мин и высушивают, после чего канал иглы просушивают путём продувания диэтиловым эфи- ром или спиртом с помощью шприца либо резиновой груши. Иглы, заг- рязнённые гноем, тащельно моют, просвет промывают проточной водой; затем помещают на 1 ч в дезинфицирующий раствор, дополнительно промывая канал с помощью шприца или резиновой груши, и подвергают такой же дальнейшей обработке, как не загрязнённые гноем иглы.
Системы для трансфузии лекарственных веществ или крови разового пользования, но вынужденно применяемые повторно. Проводят тщательную обработку для предупреждения посттрансфузионных реакций и осложнений. В современных условиях используют разовые системы для трансфузии, стерилизованные в заводских условиях. Систему многоразового использования сразу после переливания крови или лекарственного препарата разбирают - разъединяют стеклянные части, капельницу и резиновые трубки, тщательно промывают проточной водой, разминая пальцами резиновую трубку (для лучшего удаления остатков крови). Части системы опускают на 2 ч в подогретый до 60 ?С специальный раствор, содержащий 1% раствор натрия гидрокарбоната и 1% раствор аммиака. Затем части системы промывают проточной водой и кипятят в дистиллированной воде 30 мин, вновь промывают водой, разминая резиновые трубки, и повторно кипятят 20 мин в дистиллированной воде. После этого систему монтируют и упаковывают для стерилизации.
Резиновые перчатки. В современной практике используют перчатки разового пользования, стерилизованные в заводских условиях. При необходимости повторного использования перчатки, загрязнённые кровью, моют, не снимая с рук, проточной водой до полного удаления крови, просушивают полотенцем и помещают на 30 мин в 0,5% раствор аммиака либо в моющий и дезинфицирующий раствор. Затем тщательно моют проточной водой, вывешивают на веревке для просушивания, после чего упаковывают для стерилизации.
Резиновые перчатки, загрязнённые гноем или кишечным содержимым, подлежат уничтожению. При крайней необходимости их моют в проточной воде и помещают в моющий и дезинфицирующий раствор на 1 час, ополаскивают проточной водой и упаковывают для стерилизации. Эти перчатки могут использоваться для работы в гнойной перевязочной.
Для контроля полноты удаления крови с предметов, прошедших пред- стерилизационную обработку, используют бензидиновую пробу: на предмет наносят по 3 капли 1% раствора бензидина и пероксида водорода. Появление сине-зелёной окраски указывает на следы крови, оставшейся на предметах. В этом случае необходима повторная обработка.
Этап II - укладка и подготовка к стерилизации
Для стерилизации в сухожаровых стерилизаторах инструменты помещают в металлические коробки, укладывая их вертикально в один слой. Шприцы в разобранном виде заворачивают в 2 слоя специальной плотной бумаги. Крышки от коробок стерилизуют рядом. В последнее время в основном применяются шприцы разового пользования, стерилизованные в заводских условиях.
Для стерилизации паром под давлением в паровых стерилизаторах (автоклавах) инструменты заворачивают в вафельное полотенце или хлопчатобумажную ткань в виде пакета и укладывают на металличес- кий поднос или сетку. Для конкретных типичных операций набор инструментов подготавливают заранее (например, для операций на лёг- ком, сердце, костях, сосудах), укладывают на специальную сетку и заворачивают в простыню в виде пакета.
Цилиндр и поршень шприца укладывают отдельно в марлевые салфетки и заворачивают в кусок хлопчатобумажной ткани в виде пакета, который помещают в стерилизационную коробку (бикс). При массовой стерилизации шприцев в автоклавах (централизованная стерилизация) используют специальную укладку, сшитую из хлопчатобумажной ткани, с карманами. В карманы помещают шприцы в разобранном виде, рядом - иглы и пинцет. В каждой укладке содержится до 5 шприцев.
Укладки заворачивают в хлопчатобумажную пелёнку в виде пакета и помещают в стерилизатор.
Сухие резиновые перчатки пересыпают тальком (снаружи и внутри), прокладывают марлевыми салфетками, попарно заворачивают в салфетку и укладывают в отдельный бикс.
Собранные системы для переливания крови проверяют на прочность резиновых трубок, плотность соединения их со стеклянными деталями и соответствие канюлей павильонам иглы. Систему сворачивают в виде 2-3 колец, не допуская перегиба резиновых трубок, заворачивают в большую марлевую салфетку, затем - в вафельное полотенце и укладывают в биксы.
Этап III - стерилизация
Стерилизацию инструментов, шприцев (с отметкой на шприце 200 ?С), игл, стеклянной посуды проводят в сухожаровых шкафах-стерилизаторах (рис. 4). Предметы свободно укладывают на полках стерилизатора в
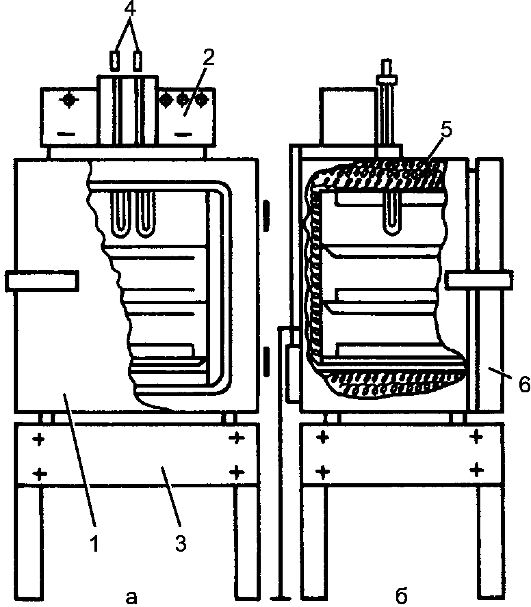
Рис. 4. Сухожаровой шкаф-стерилизатор (схема): а - вид спереди; б - вид сбоку; 1 - корпус; 2 - пульт управления; 3 - подставка; 4 - термометры (контактный и транзисторный терморегуляторы); 5 - электронагревательные элементы; 6 - дверца шкафа.
металлических коробках (при снятых крышках) и включают подогрев. При открытой дверце доводят температуру до 80-85 ?С и в течение 30 мин просушивают - удаляют влагу с внутренних поверхностей шкафа и стерилизуемых предметов. Затем дверцу закрывают, доводят температуру до заданной (180 ?С), поддерживая её автоматически, и стерилизуют в течение 60 мин. После отключения системы подогрева и снижения температуры до 70-50 ?С открывают дверцу шкафа и стерильным инструментом закрывают крышками металлические коробки с инструментами. Через 15-20 мин (после полного охлаждения стерилизатора) камеру разгружают.
При работе с сухожаровым стерилизатором необходимо соблюдать меры безопасности: аппарат должен быть заземлён, по окончании стерилизации следует открывать дверцу шкафа только при снижении температуры до 70-50 ?С. Запрещается пользоваться неисправным аппаратом.
Стерилизацию инструментов, шприцев, систем для переливания крови можно производить в паровом стерилизаторе (автоклаве) (рис. 5).
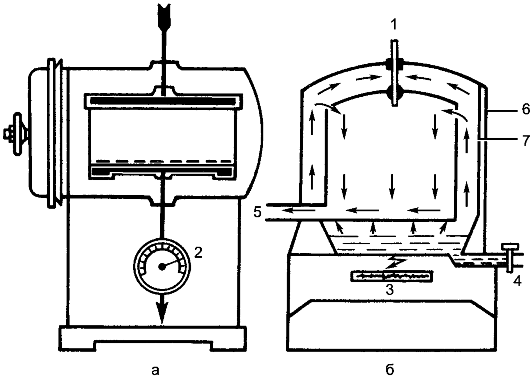
Рис. 5. Паровой стерилизатор (автоклав), схема его устройства: а - вид сбоку; б - вид спереди; 1 - термометр; 2 - манометр; 3 - источник тепла; 4 - вводный кран; 5 - выпускной кран; 6 - наружная стенка стерилизатора; 7 - внутренняя стенка стерилизатора.
Упакованные предметы укладывают в стерилизационную камеру. Если упаковки уложены в биксы, то их решетки должны быть открыты. Биксы или другие упаковки укладывают свободно, чтобы пар распределялся равномерно.
Хирургические инструменты и шприцы стерилизуют в течение 20 мин при 2 атм1, что соответствует температуре 132,9 ?С. Время начала стерилизации отсчитывают с момента достижения соответствующего давления. Резиновые перчатки, системы для переливания крови, резиновые дренажные трубки стерилизуют при 1,1 атм (температура пара 120 ?С) в течение 45 мин. При разгрузке автоклава закрывают отверстия в биксах.
Методы стерилизации в сухожаровых и паровых стерилизаторах следует рассматривать как основные. Метод стерилизации кипячением применяют в небольших лечебных учреждениях, где нет централизованной стерилизационной. Используют стационарные или портативные электрические кипятильники, в которых можно стерилизовать инструменты, шприцы, иглы, предметы из стекла, резиновые дренажи, катетеры, перчатки.
В кипятильник наливают дистиллированную воду, для повышения температуры кипения воды и разрушения оболочки бактерий добавля- ют 20 г натрия гидрокарбоната на 1 л воды (2% раствор). На дно кипятильника укладывают тонкий простёганный слой из ваты с марлей, чтобы выпадающие соли в виде накипи оседали на нём, а не на инструментах.
Инструменты в разобранном виде укладывают на специальные сетки и опускают крючками на дно кипятильника, оставляя ручки крюч- ков снаружи, и закрывают кипятильник крышкой. Время стерилизации - 40 мин с момента закипания воды. По окончании стерилизации сетку с инструментами подхватывают крючками, дают стечь воде и переносят на специальный столик, покрытый стерильной простынёй, сложенной в 4 слоя. Операционная сестра раскладывает инструменты на большом операционном столе.
Шприцы и иглы стерилизуют отдельно от инструментов, в разобранном виде (кипячением в дистиллированной воде без добавления гидрокарбоната натрия), в течение 45 мин. Шприцы и иглы для люмбальной пункции и внутривенных вливаний кипятят в дважды дистиллированной воде без добавления гидрокарбоната натрия.
Инструменты, шприцы и иглы, загрязнённые гноем, каловыми массами, после специальной предварительной обработки стерилизуют кипячением в течение 90 мин в отдельном кипятильнике.
11 атм = 1,013 x 105 Па
Инструменты, шприцы и иглы, применяемые у больных с газовой гангреной, подлежат тщательной обработке и последующей дробной стерилизации кипячением. Их кипятят в течение 1 ч, извлекают из ки- пятильника и оставляют при комнатной температуре на 12-24 ч (для прорастания спор), а затем повторно стерилизуют кипячением в течение 1 ч (дробная стерилизация).
Основной метод стерилизации изделий из резины (дренажей, катетеров, перчаток) - автоклавирование. В исключительных случаях их подвергают кипячению в течение 15 мин.
Стерилизацию инструментов и предметов, не подлежащих термической обработке (эндоскопов, торакоскопов, лапароскопов, аппаратов или блоков аппаратов для искусственного кровообращения, гемосорбции), осуществляют в специальном газовом стерилизаторе ГПД-250. Предметы для стерилизации помещают в герметичную стерилизационную камеру (рис. 6), которую наполняют окисью этилена. Время экспозиции - 16 ч при температуре 18 ?С. Стерилизация может проводиться также смесью окиси этилена и бромида метилена при температуре 55 ?С в течение 6 ч.
Стерилизация инструментов и оптических аппаратов (лапароскопов, торакоскопов) может быть проведена в спиртовом растворе хлоргексидина и первомуре. При такой стерилизации (химическими средствами) применяют металлические коробки с крышками, что предупреждает испарение препарата и загрязнение воздуха помещений; при отсутствии специальной посуды используют эмалированную или стеклянную. Инструменты заливают раствором (чтобы он полностью покрывал их) и закрывают крышкой.
В экстренных случаях, когда невозможно обеспечить стерилизацию инструментов ни одним из указанных способов, используют метод обжигания. В металлический тазик или лоток наливают 15-20 мл спирта, несколько инструментов укладывают на дно и поджигают спирт. Метод обжигания недостаточно надёжен, пожаро- и взрывоопасен (наличие кислорода, паров наркотических веществ в воздухе помещений), поэтому к нему прибегают в исключительных случаях, строго соблюдая меры пожарной безопасности.
Режущие инструменты (скальпели, ножницы) при стерилизации обычными методами затупляются, поэтому её проводят практически без термической обработки. После предстерилизационной подготовки инструменты погружают в 96% раствор этанола на 30 мин или в тройной раствор на 3 ч. Допускается лишь краткосрочное кипячение режущих инструментов. Скальпели укладывают в отдельную сетку, их лезвия обёр- тывают марлей и кипятят в дистиллированной воде без добавления гидрокарбоната натрия в течение 10 мин, затем помещают в 96% раствор этанола на 30 мин.
Этап IV - хранение стерильного материала
Стерильный материал хранят в специальном помещении. Не допускается хранение в одном помещении нестерильных и стерильных материалов. Стерильность материала в биксах (если они не открывались) сохраняется в течение 48 ч. Если материалы были помещены в полотняные упаковки (полотенца, простыни, пелёнки) и для стерилизации уложены в биксы (например, системы для переливания крови, резиновые дренажи, шприцы), они могут храниться в этих биксах до 3 сут. При централизованной стерилизации шприцы сохраняют стерильность в течение 25 дней.
Стерилизация перевязочного материала, операционного белья Этап I - предстерилизационная подготовка материала
К перевязочному материалу относятся марлевые шарики, салфетки, тампоны, турунды, бинты. Применяют их во время операции и перевязки с целью осушения раны, остановки кровотечения, дренирования или тампонады раны. Перевязочный материал готовят из марли и ваты, реже - из вискозы и лигнина. Он должен обладать следующими свойствами:
1) быть биологически и химически интактным, не оказывать отрицательного влияния на процессы заживления;
2) обладать хорошей гигроскопичностью;
3) быть минимально сыпучим, так как отделившиеся нити могут остаться в ране как инородные тела;
4) быть мягким, эластичным, не травмировать ткани;
5) легко стерилизоваться и не терять при этом своих свойств;
6) быть дешёвым в производстве (с учётом большого расхода материала); норма расхода за год на 1 хирургическую койку - 200 м марли и 225 бинтов; только на такую небольшую операцию, как аппендэктомия, расходуется около 7 м марли.
Перевязочный материал готовят из марли, предварительно разрезанной на кусочки. Марлю складывают, подвёртывая края внутрь, чтобы не было свободного края (из него могут осыпаться волокна ткани). Материал заготавливают впрок, пополняя его запасы по мере расходования. Для удобства подсчёта расходуемого во время операции материала его укладывают перед стерилизацией определённым образом: шарики - в марлевые мешочки по 50-1000 штук, салфетки - в связки по 10 штук. Перевязочный материал, кроме бинтов, не загрязнённых кровью, после применения сжигают.
К операционному белью относятся халаты хирургические, простыни, полотенца, маски, шапочки, бахилы. Материалом для их изготовления служат хлопчатобумажные ткани - бязь, полотно. Операционное бельё многоразового пользования должно иметь специальную метку и сдаваться в стирку отдельно от другого белья, в специальных мешках. У халатов не должно быть карманов, поясов; простыни должны был подшиты. Халаты, простыни, пелёнки, полотенца для стерилизации складывают в виде рулонов, чтобы их легко можно было развернуть при использовании.
Этап II - укладка и подготовка материала к стерилизации.
Перевязочный материал и операционное бельё укладывают в биксы (рис. 7). При отсутствии биксов допускается стерилизация в полотняных мешках.
При универсальной укладке в бикс (мешок) помещают материал, предназначенный для одной небольшой типичной операции (аппендэктомии, грыжесечения, флебэктомии и др.). При целенаправленной укладке в бикс (мешок) закладывают необходимый набор перевязочного мате-
Рис. 7. Бикс Шиммельбуша.
риала и операционного белья, предназначенного для конкретной операции (пневмонэктомии, резекции желудка и др.). При видовой укладке в бикс укладывают определённый вид перевязочного материала или белья (бикс с халатами, бикс с салфетками, бикс с шариками и т.д.).
Вначале проверяют исправность бикса, затем на его дно помещают развёрнутую простыню, концы которой находятся снаружи. Перевязочный материал укладывают вертикально по секторам пачками или паке- тами. Материал укладывают неплотно, чтобы обеспечить доступ пара, внутрь помещают индикаторы режима стерилизации (максимальные термометры, плавящиеся вещества или пробирки с тест-микробом), края простыни заворачивают, бикс закрывают крышкой и защёлкивают замок. К крышке бикса прикрепляют бирку из клеёнки с указанием даты стерилизации и фамилии осуществлявшего её.
При стерилизации в мешке перевязочный материал или бельё укладывают неплотно, мешок завязывают тесёмками, опускают его в другой такой же мешок и завязывают. При необходимости использования ма- териала мешок помешают на табурет, санитарка развязывает верхний мешок, разводит его края и сдвигает книзу. Операционная сестра развязывает внутренний мешок стерильными руками, раскрывает его и извлекает материал.
Этап III - стерилизация
Эксплуатация автоклава допускается только при наличии разрешения Инспекции котлонадзора с отметкой в паспорте аппарата. К работе с автоклавом допускаются лица, сдавшие технический минимум по эксплуа- тации автоклава и имеющие соответствующее разрешение. Работа с автоклавом требует точного соблюдения инструкции по эксплуатации аппарата. Необходимо соблюдать общие правила техники безопасности:
• обязательно заземлять паровой стерилизатор с электрическим подогревом;
• не приступать к работе на неисправном аппарате;
• во время работы не оставлять аппарат без присмотра;
• не доливать воду в воронку во время работы стерилизатора;
• по окончании стерилизации отключать нагреватель от сети и прикрывать вентиль впуска пара в стерилизационную камеру из парообразователя;
• открывать крышку стерилизационной камеры только после того, как стрелка манометра опустится до нуля.
Отсчёт времени стерилизации начинается с момента достижения заданного давления. Перевязочный материал и операционное бельё стерилизуют в течение 20 мин при давлении 2 атм (температура 132,9 ?С).
Этап IV - хранение стерильного материала
По окончании стерилизации и сушки белья стерилизационную камеру разгружают, биксы вынимают, сразу закрывают решётку и переносят их на специальный стол для стерильного материала. Хранят биксы в шкафах под замком в специальной комнате. Допустимый срок хранения перевязочного материала и белья, если бикс не вскрывался, - 48 ч с момента окончания стерилизации. Материал и бельё, стерилизованные в мешках, хранят не более 24 ч.
Контроль стерильности
Контроль стерильности материала и режима стерилизации в автоклавах проводят прямым и непрямым (косвенным) способами. Прямой способ - бактериологический: посев с перевязочного материала и белья или использование бактериологических тестов. Посев производят следующим образом: в операционной вскрывают бикс, маленькими кусочками марли, увлажнённой изотоническим раствором хлорида натрия, несколько раз проводят по белью, после чего кус


